Bài 1: CẤU TRÚC CỦA CHẤT. SỰ CHUYỂN THỂ
👀 66
❤️ 2
Cập nhật gần nhất: 5 months ago
I. MÔ HÌNH ĐỘNG HỌC PHÂN TỬ VỀ CẤU TẠO CHẤT
1. Các chất được cấu tạo từ các hạt riêng biệt
Mọi chất xung quanh ta (nước, không khí, kim loại,…) đều được tạo nên từ những hạt rất nhỏ gọi là phân tử.
Phân tử là đơn vị nhỏ nhất của chất, vẫn giữ nguyên tính chất hóa học của chất đó.
Giữa các phân tử có khoảng cách nhất định, vì vậy vật rắn, lỏng, khí không liền khối mà là tập hợp vô số hạt nhỏ li ti.
2. Các phân tử chuyển động không ngừng
Các phân tử luôn luôn chuyển động:
Ở thể khí → chuyển động rất nhanh và hỗn loạn.
Ở thể lỏng → chuyển động chậm hơn nhưng vẫn hỗn loạn.
Ở thể rắn → chỉ dao động quanh vị trí cố định.
Nhiệt độ càng cao → tốc độ chuyển động của phân tử càng lớn.
Ví dụ: Khi đun nước, phân tử nước chuyển động nhanh hơn, khiến nước nóng lên và có thể bay hơi.
3. Lực liên kết phân tử
Giữa các phân tử tồn tại lực hút và lực đẩy:
Ở khoảng cách rất gần → lực đẩy mạnh (phân tử không chồng lên nhau).
Ở khoảng cách vừa phải → lực hút xuất hiện, giúp các phân tử gắn kết.
Hai loại lực này được gọi chung là lực liên kết phân tử.
4. Chuyển động Brown
Năm 1827, nhà khoa học Robert Brown quan sát các hạt phấn hoa nhỏ trong nước bằng kính hiển vi và thấy:
Các hạt này chuyển động hỗn loạn, liên tục.
Chuyển động này không do dòng nước hay gió, mà là do các phân tử nước va chạm vào hạt phấn.
Hiện tượng này được gọi là chuyển động Brown, là bằng chứng trực tiếp cho thấy các phân tử luôn chuyển động.

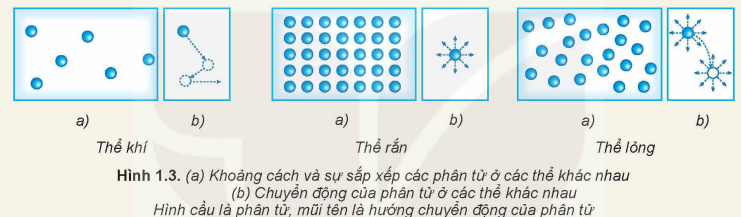
II. CẤU TRÚC CỦA CHẤT RẮN, CHẤT LỎNG VÀ CHẤT KHÍ
I. Nguyên tắc chung
Hai yếu tố quan trọng quyết định cấu trúc của các trạng thái vật chất là:
1.Khoảng cách giữa các phân tử
Khoảng cách càng lớn → lực liên kết yếu.
Khoảng cách càng nhỏ → lực liên kết mạnh.
2.Cách sắp xếp của các phân tử
Sắp xếp có trật tự → lực liên kết mạnh, hình dạng ổn định.
Sắp xếp lộn xộn, hỗn loạn → lực liên kết yếu, hình dạng dễ thay đổi.
II. Cấu trúc của từng trạng thái vật chất
1) Chất rắn
Khoảng cách giữa các phân tử rất nhỏ → lực liên kết rất mạnh.
Sắp xếp: có trật tự, thường theo dạng mạng tinh thể.
Chuyển động của phân tử: chỉ dao động quanh vị trí cân bằng, không di chuyển xa được.
Hệ quả:
Hình dạng và thể tích cố định.
Khó nén, khó thay đổi thể tích.
Ví dụ: sắt, đá, muối, đường.
2) Chất lỏng
Khoảng cách: lớn hơn chất rắn → lực liên kết yếu hơn.
Sắp xếp: vẫn có trật tự nhất định nhưng không chặt chẽ, các phân tử có thể trượt qua nhau.
Chuyển động của phân tử: vừa dao động vừa trượt, đổi chỗ cho nhau.
Hệ quả:
Có thể tích cố định nhưng hình dạng thay đổi theo bình chứa.
Khó nén, nhưng dễ chảy.
Ví dụ: nước, dầu, rượu.
3) Chất khí
Khoảng cách: rất lớn so với kích thước phân tử → lực liên kết rất yếu (gần như không đáng kể).
Sắp xếp: hoàn toàn hỗn loạn, không trật tự.
Chuyển động của phân tử: hỗn loạn, nhanh, theo mọi hướng.
Hệ quả:
Không có hình dạng và thể tích cố định.
Dễ bị nén và giãn nở.
Ví dụ: không khí, khí oxi, khí CO₂.
III. So sánh nhanh
| Đặc điểm | Chất rắn | Chất lỏng | Chất khí |
|---|---|---|---|
| Khoảng cách | Rất nhỏ | Lớn hơn chất rắn | Rất lớn |
| Lực liên kết | Rất mạnh | Yếu hơn | Rất yếu |
| Sắp xếp | Rất trật tự | Kém trật tự hơn | Hoàn toàn hỗn loạn |
| Chuyển động | Dao động tại chỗ | Trượt và dao động | Chuyển động hỗn loạn |
| Hình dạng | Cố định | Thay đổi theo bình chứa | Không cố định |
| Thể tích | Cố định | Cố định | Không cố định |
Kết luận dễ nhớ:
Chất rắn: gần – chặt – mạnh
Chất lỏng: gần vừa – hơi lỏng lẻo – trượt
Chất khí: xa – rời rạc – tự do bay nhảy
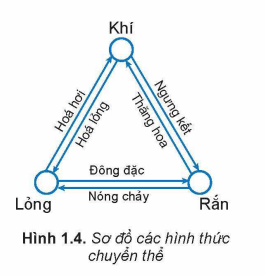
III. SỰ CHUYỂN THỂ
1. Khái niệm
Chất có thể tồn tại ở 3 trạng thái: rắn, lỏng, khí. Khi thay đổi nhiệt độ hoặc áp suất, chất có thể chuyển từ trạng thái này sang trạng thái khác.
Rắn → Lỏng: nóng chảy
Lỏng → Khí: bay hơi, sôi
Rắn → Khí: thăng hoa
Và ngược lại:
Khí → Lỏng: ngưng tụ
Lỏng → Rắn: đông đặc
Khí → Rắn: thăng hoa
Hình 1.4 minh họa sơ đồ các quá trình chuyển thể.
2. Giải thích bằng thuyết động học phân tử
Theo thuyết động học phân tử, sự chuyển thể xảy ra khi năng lượng (nhiệt lượng) của các phân tử thay đổi:
- Khi nhiệt độ tăng, phân tử dao động mạnh hơn, khoảng cách giữa chúng lớn dần → liên kết yếu đi → chất thay đổi trạng thái.
- Khi nhiệt độ giảm, chuyển động chậm lại, liên kết bền hơn → chất trở về trạng thái ban đầu.
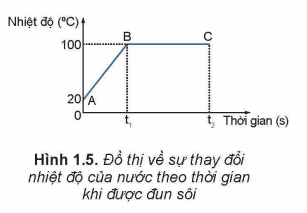
3. Sự sôi và bay hơi
Bay hơi: xảy ra ở bất kỳ nhiệt độ nào, chỉ diễn ra trên bề mặt chất lỏng.
Sôi: xảy ra khi nhiệt độ đạt tới giá trị nhất định (nhiệt độ sôi). Khi đó, bong bóng hơi hình thành và thoát ra khắp chất lỏng.
Ví dụ: Ở áp suất khí quyển chuẩn, nước sôi ở 100°C. Khi áp suất thay đổi (như ở vùng núi cao), nhiệt độ sôi của nước cũng thay đổi.
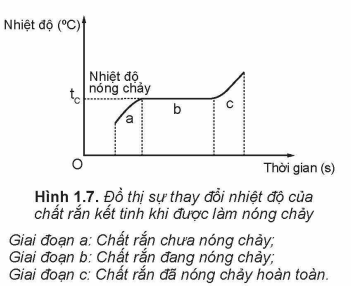
4. Sự nóng chảy và đông đặc
Nóng chảy: rắn → lỏng, xảy ra ở nhiệt độ xác định (nhiệt độ nóng chảy).
Đông đặc: lỏng → rắn, xảy ra ở cùng nhiệt độ với nóng chảy (nếu áp suất không đổi).
Ví dụ: Nước đá nóng chảy ở 0°C.
5. Thăng hoa và ngưng kết
Thăng hoa: rắn → khí (ví dụ: băng khô).
Ngưng kết: khí → rắn (ví dụ: sương giá bám trên cửa kính).
📌 Tóm tắt dễ nhớ:
Bay hơi: mọi nhiệt độ, bề mặt chất lỏng.
Sôi: nhiệt độ xác định, khắp chất lỏng.
Nóng chảy / Đông đặc: nhiệt độ xác định, ngược nhau.
Thăng hoa / Ngưng kết: rắn ↔ khí.
Bài tập ôn tập (41 tổng câu hỏi)
*Lưu ý: làm hết câu này rồi đến câu khác. Xin đừng nôn nóng.Đang tải câu hỏi...
